Patología del trasplante renal
Parte 1: Generalidades,
evaluación histológica del riñón
donante, rechazo (generalidades), rechazo
hiperagudo, rechazo agudo acelerado, rechazo
agudo, clasificación de Banff
Parte 2:
Rechazo crónico y nefropatía crónica/esclerosante del injerto,
toxicidad por ciclosporina y tacrolimus, toxicidad por otros medicamentos
Parte 3: Infección
por poliomavirus, infección por citomegalovirus, otras infecciones, enfermedades
recurrentes y glomerulopatías de novo, neoplasias.
El trasplante renal es en la actualidad un procedimiento rutinario en la mayoría de grandes centros hospitalarios del mundo; el éxito de este tipo de tratamiento es el resultado de muchos años de investigación en medicina clínica, quirúrgica y ciencias básicas. Es curioso, pero en la mayoría de textos que hablan de la historia del trasplante no se menciona un importantísimo acontecimiento que parece ser el primer trasplante renal entre humanos; fue realizado en 1933 por el cirujano ruso Yu Yu Voronoy, en Ucrania, quien trasplantó un riñón extraído a un hombre de 60 años, muerto accidentalmente, a otro receptor humano. El riñón fue implantado en la región inguinal, bajo anestesia local, y la receptora sobrevivió 4 días. Los resultados de este primer trasplante fueron publicados en la desaparecida revista española El Siglo Médico, en 1936, traducidos del ruso por el urólogo español Emilio de la Peña, quien había trabajado en Rusia junto a Voronoy (Hamilton DN, Reid WA. Yu. Yu. Voronoy and the first human kidney allograft. Surg Gynecol Obstet 159:289-94, 1984 [PubMed link]; Maganto-Pavón E. Historia del trasplante renal. En: González-Martín M, García-Buitrón JM (eds). Trasplante renal. Madrid: Aula Médica Ediciones, 2000; pp. 1-14).
En las últimas décadas el desarrollo alcanzado en trasplante renal ha permitido lograr altas tasas de supervivencia del injerto. Las alteraciones y complicaciones en los primeros días postrasplante son hoy suficientemente conocidas y se ha avanzado bastante en su prevención y manejo, lográndose una mejoría dramática en la supervivencia a corto plazo. Las principales causas de disfunción en esta primera fase incluyen rechazo agudo, trombosis y necrosis tubular aguda, entre otras. Una mejoría en el mantenimiento del donante y la preservación del órgano, adecuadas técnicas quirúrgicas y la introducción de nuevos medicamentos inmunosupresores han contribuido grandemente a este avance. Sin embargo, la supervivencia del injerto a largo plazo sigue siendo considerado uno de los mayores obstáculos para el éxito del trasplante renal. La mejoría futura en la supervivencia del injerto dependerá en gran parte de un mejor entendimiento y manejo de la fibrosis intersticial / atrofia tubular (IFTA), ya que en la patogénesis de ésta juegan un papel importante mecanismos inmunológicos y no inmunológicos.
Entre los mecanismos no inmunológicos están los factores del donante (incluida la calidad del tejido renal), la toxicidad por medicamentos, las alteraciones obstructivas, recurrencia de la enfermedad de base, infecciones, etcétera.
La evaluación histológica del injerto renal se utiliza, principalmente, para saber porqué hay alteraciones en su función. Las causas de disfunción pueden ser: rechazo agudo o crónico, necrosis tubular aguda (NTA), infecciones, obstrucción vascular (trombosis o estenosis), obstrucción de vías urinarias, toxicidad por medicamentos y enfermedades recurrentes o de novo. Además de determinar la causa de la disfunción, debemos tratar de graduar su severidad y de determinar si la lesión es o no reversible.
Hemos dividido esta sección en varios apartados, en primer lugar evaluación histológica del riñón donante; en segundo lugar rechazo y nefropatía crónica/esclerosante del injerto; en tercer lugar toxicidad por medicamentos; en el cuarto infecciones del injerto; en el quinto enfermedades recurrentes o de novo y, finalmente, enfermedades linfoproliferativas.
EVALUACIÓN HISTOLÓGICA DEL RIÑÓN DONANTE
La calidad de un órgano donante se evalúa por las características clínicas y paraclínicas del donante, la evaluación histológica, al menos en donantes sin enfermedad de base, no es esencial. Sin embargo, cada vez es más frecuente obtener órganos de donantes con enfermedades crónicas u otras características que hacen que no sea un "donante ideal"; a estos donantes se les suele llamar también "donantes subóptimos" o "donantes marginales". En muchos de estos casos, principalmente debido a edad avanzada (>55 ó 60 años), enfermedad vascular sistémica u otras enfermedades que pueden afectar al riñón, es necesaria una evaluación más cuidadosa de los órganos a trasplantar.
En riñones, muchos autores han pregonado límites para determinar que órganos deberían descartarse, sin embargo, muchos trabajos han demostrado que no hay un límite exacto de lesiones para decidir o no trasplantar un riñón. Esta decisión depende de un juicioso análisis de las características del donante, condiciones de la muerte y de preservación del órgano, y aspectos morfológicos. Así que el estudio histológico es sólo una parte de la información que debe tenerse en cuanta para trasplantar o descartar riñones. Algunos grupos utilizan el límite de 20% de glomeruloesclerosis (GE) para descartar el riñón, otros utilizan el 25%, algunos dicen que las lesiones vasculares tienen mejor correlación con el pronóstico, y otros, entre ellos nosotros, hemos encontrado que la fibrosis intersticial es mejor indicador del daño renal crónico y no deberíamos basar la decisión sólo en el porcentaje de GE (Arias LF, et al. Blanco J, Sanchez-Fructuoso A, Prats D, Duque E, Sáiz-Pardo M, Ruiz J, Barrientos A. Histologic assessment of donor kidneys and graft outcome: multivariate analyses. Transplant Proc. 2007;39(5):1368-70 [PubMed link]).
Liapis H, et al; Banff Working Group. Banff Histopathological Consensus Criteria for Preimplantation Kidney Biopsies. Am J Transplant. 2017;17(1):140-150. [PubMed link]
Hay indicaciones "casi" obligatorias para el estudio histológico del donante: lesiones sospechosas de neoplasia, quistes hemorrágicos (más probabilidad de ser de origen neoplásico) y cuando el aspecto del riñón sugiere infarto o lesiones crónicas severas.
Al momento de evaluar un órgano para trasplante es necesario obtener los cortes histológicos muy pronto, idealmente por procesamiento rápido (la mayoría de estos aparatos lo hace en 1 ó 2 horas); o por cortes por congelación, aunque la calidad no es la ideal.
Debemos evaluar y cuantificar (o semicuantificar) el porcentaje de lesiones crónicas del riñón: GE, fibrosis intersticial, atrofia tubular, fibrosis intimal de arterias y arteriolosclerosis hialina (ah). Además, debemos tratar de identificar otras alteraciones glomerulares, vasculares o túbulo-intersticiales.
Las biopsias del donante o biopsias pretrasplante o postperfusión, no se hacen rutinariamente en todos los centros; en muchos sólo se realiza en los donantes con mayor riesgo de función inadecuada del injerto, como aquellos mayores de 55 ó 60 años, hipertensión, diabetes mellitus, depuración de creatinina disminuida, proteinuria u otra alteración. La biopsia del donante es recomendable porque proporciona datos con los que podrán compararse las alteraciones observadas en futuras biopsias. Muchos autores han argumentado que una adecuada valoración “rutinaria” del donante debería incluir una biopsia pretrasplante del órgano donado. La evaluación histológica del riñón aporta datos del estado del órgano que no pueden ser deducidos de los hallazgos clínicos y del estudio de la función renal.
Al estudiar la biopsia renal de un donante, el tamaño de ésta y su contenido de glomérulos y vasos es variable ¿cuál debe ser el tamaño de una muestra para que sea universalmente considerada adecuada? Es una pregunta no resuelta y, aunque es cierto que a mayor número de glomérulos y vasos más adecuada será la evaluación, diferentes estudios y grupos utilizan parámetros mínimos distintos. Algunos autores encuentran que la GE no se correlaciona con la pérdida de la función del injerto a menos que el especimen de biopsia contenga más de 25 glomérulos; otros consideran adecuadas las biopsias con un mínimo de 20 glomérulos; otros sugieren un mínimo de 7 glomérulos para adultos y de 13 en niños, o un fragmento de 2 mm cuadrados, y algunos incluyen en sus estudios casos con 6 glomérulos o más, sin encontrar diferencias significativas entre casos que contengan pocos o muchos.
La técnica más utilizada suele ser una biopsia en cuña, que, a diferencia de las biopsias con aguja, toma tejido cortical superficial. Las zonas renales subcapsulares tienen un mayor grado de glomeruloesclerosis, fibrosis intersticial y atrofia tubular, lo cual es un hecho importante dado que puede sobrevalorar las alteraciones del parénquima; la base anatómica para esta observación es que la zona subcapsular es la zona más distal del flujo sanguíneo arterial y, por lo tanto, más propensa a cambios isquémicos relacionados con la edad. De igual manera, se sabe que las lesiones vasculares tienden a afectar preferentemente los vasos más profundos cercanos a la unión corticomedular.
Para obtener una adecuada cantidad de tejido, se recomienda una cuña de 10 mm de amplitud en la superficie renal y al menos 5 mm de profundidad, para asegurar una evaluación cercana a la mitad del espesor cortical, y tratando de evitar que la muestra se limite al área subcapsular que puede tener más cicatrices y glomérulos esclerosados, no representativos del resto del parénquima.
Otro aspecto importante que se debe tener en cuenta cuando se valora una biopsia renal, es el hecho de que sólo corresponde a un área muy limitada de todo el parénquima y algunas alteraciones son focales, por lo que una biopsia que tome fragmentos cicatriciales o con otras alteraciones limitadas a una pequeña zona del tejido, también sobrevalorará el daño crónico del órgano. (Muruve NA, et al. Are wedge biopsies of cadaveric kidneys obtained at procurement reliable? Transplantation 69:2384-8, 2000. [PubMed link]; Carrera M, et al. Biopsia del donante en el trasplante renal. Revista Española de Patología 35: 295-299, 2002 [Free full text]; Randhawa P. Role of donor kidney biopsies in renal transplantation. Transplantation. 71:1361-5, 2001 [PubMed link]).
Liapis H, et al; Banff Working Group. Banff Histopathological Consensus Criteria for Preimplantation Kidney Biopsies. Am J Transplant. 2017;17(1):140-150. [PubMed link]
La respuesta del receptor a un tejido extraño es un mecanismo esencial en la supervivencia de las especies, por lo tanto, la agresión contra el injerto es la respuesta lógica después de un trasplante. En cada individuo esa respuesta es diferente y depende en gran parte de lo distintos que sean los antígenos del donante con respecto a los del receptor, de la modulación que logre alcanzarse con los inmunosupresores y de otros muchos factores, algunos no bien identificados aún. Esta variabilidad en la respuesta inmune contra el injerto produce diferentes manifestaciones clínicas y hace que la supervivencia del órgano sea distinta en cada receptor.
Esta variabilidad ha llevado a la clasificación
del rechazo en:
Rechazo hiperagudo: Falla del injerto en los
primeros minutos u horas después del trasplante debida a mecanismos inmunológicos
(inmunidad por anticuerpos preformados). Es un diagnóstico clínico.
Rechazo agudo acelerado: Es una forma de rechazo
que se desarrolla en 1 a 2 semanas después del trasplante, con alteraciones
severas de la función y de la morfología renal (lesiones vasculares
severas).Suele ser un rechazo mediado por anticuerpos y se le ha llamado
también rechazo humoral retardado.
Rechazo agudo: Puede presentarse en cualquier
momento después del trasplante, pero, es más frecuente después
de la primera semana y en el primer mes. Puede ser mediado por inmunidad celular, por inmunidad humoral o por ambos mecanismos.
Rechazo crónico: Es un descenso progresivo
de la función renal de causa inmunológica que inicia, por convención,
después del tercer mes post-trasplante. Puede ser mediado por inmunidad celular, por inmunidad humoral o por ambos mecanismos.
La anterior clasificación es clínico-patológica y, en alguna medida, basada en la patogenia. Diferente es la clasificación histopatológica que veremos más adelante.
El término “fibrosis intersticial y atrofia tubular sin evidencia de etiología específica” (hasta hace unos años llamada: nefropatía crónica/esclerosante del injerto): Es el daño crónico (fibrosis y atrofia tubular) del injerto, en el que no logra evidenciarse en el estudio histológico una causa del daño crónico. Es un diagnóstico inespecífico y puede deberse a muchas causas, entre ellas a rechazo, toxicidad por medicamentos, infecciones, etcétera. El verdadero reto para todos es diagnosticar la causa de este daño crónico en cada caso, una tarea nada fácil.
La clasificación histopatológica del rechazo fue formulada desde principios de los noventa y es revisada y refinada periodicamente: la Clasificación de Banff. Es una clasificación mundialmente aceptada, pero, no exenta de dificultades y de algunos problemas de reproducibilidad: no hay clasificación 100% reproducible entre observadores (Furnes P, et al. International variation in histologic grading is large, and persistent feedback does not improve reproducibility Am J Surg Pathol. 2003 Jun;27(6):805-10. [PubMed link]). Esta clasificación ha sido modificada en los últimos años dada la importancia que ha cobrado la detección de indicadores de rechazo humoral, principalmente depósitos de C4d, un componente del complemento que se liga covalentemente a las paredes de capilares peritubulares y glomerulares, y permanece más tiempo en el tejido que las otras fracciones, siendo más fácilmente detectado. Recordemos que el C4 se activa, principalmente, por la vía clásica del complemento (por anticuerpos) y por lo tanto nos sugiere una reacción humoral.
La patogénesis del rechazo es bastante compleja y hay múltiples textos y trabajos al respecto. Por muchos años se consideró el rechazo casi exclusivamente como un mecanismo de hipersensibilidad retardada (celular) contra antígenos del sistema mayor de histocompatibilidad humano (HLA), tanto de tipo II como de tipo I. Sin embargo, hoy en día sabemos que hay más determinantes antigénicos (llamados en muchos textos antígenos menores) y que hay respuesta humoral en algunos o muchos de los pacientes. De la respuesta mediada por anticuerpos sabemos menos, pero es un tema de intensa investigación en la actualidad. Además del rechazo por anticuerpos preformados (rechazo hiperagudo y rechazo agudo acelerado), el receptor puede desarrollar una respuesta humoral contra el injerto. El resultado de esta respuesta puede ser el rechazo agudo (leve o severo), rechazo humoral persistente que llevaría a daño del órgano o a rechazo subclínico, o respuesta humoral persistente pero sin daño del injerto: adaptación o acomodación y tolerancia).
Veremos primero las alteraciones histológicas del rechazo renal y al final presentaremos la clasificación actualizada de Banff.
Se considera el prototipo del rechazo humoral. Se desarrolla en receptores que tienen anticuerpos preformados contra antígenos del donante; estos anticuerpos pueden desarrollarse por transfusiones previas, trasplantes anteriores o por embarazos. Los anticuerpos reaccionan contra antígenos endoteliales y desencadenan severas lesiones vasculares, principalmente capilares. Es un tipo de rechazo excepcional en la actualidad debido a las pruebas que se hacen siempre entre muestras del donante y el receptor: "cross-matching". La presentación clínica es rápida, se ve el órgano cianótico, se hincha y no tiene buen flujo sanguíneo. Ocasionalmente la instalación es más gradual, en horas, debido, presumiblemente, a bajo número de anticuerpos circulantes. El riñón nunca funciona o lo hace por unos minutos. Hay manifestaciones de respuesta inflamatoria sistémica: fiebre, trombocitopenia, hemólisis intravascular y aumento de fibrina y sus fragmentos circulantes. En algunos casos puede comportarse clínicamente como un retraso en el inicio de la función debido a NTA. A pesar de un cross-match negativo se puede desarrollar un rechazo hiperagudo, aunque es un evento verdaderamente excepcional.
Histopatología
El rechazo humoral es principalmente una lesión de la microvasculatura. Inicialmente hay acumulación de plaquetas en capilares glomerulares y peritubulares, se ven con H&E como un material rosa, pálido, amorfo, algo granular y negativo con el PAS. Hacia el final de la primera hora se ven abundantes polimorfos marginados en capilares glomerulares, peritubulares, arteriolas y arterias de pequeño calibre y vénulas, con daño del endotelio. Las arterias más grandes no presentan lesiones evidentes. En el intersticio hay marcado edema y hemorragias. Los túbulos presentan necrosis epitelial severa. Hay coagulación intravascular extensa del órgano y necrosis cortical luego de las primeras 12 horas. En arterias pequeñas hay necrosis fibrinoide y, aun en el tejido necrótico, pueden identificarse múltiples trombos. No hay, o es muy escaso, infiltrado linfocítico.

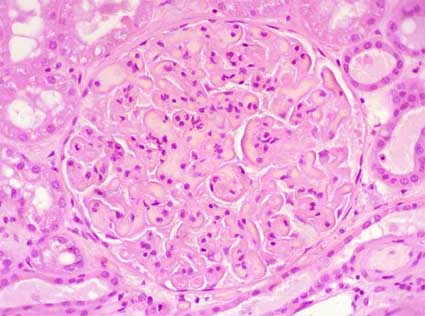
Figura 1. Glomérulo en el que se evidencia congestión capilar severa, microtrombos y polimorfos intracapilares. Observar este tipo de lesiones en todos, o casi todos los glomérulos, es muy sugerente de rechazo hiperagudo. En casos de lesiones por preservación (e isquemia - reperfusión), las lesiones suelen ser más focales y menos severas. En trombosis venosas no solemos ver la extensa marginación de capilares que vemos en estos casos. Nefrectomía de paciente con rechazo hiperagudo. (H&E, X400).
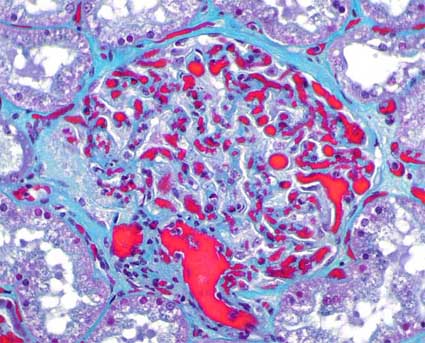
Figura 2. En el mismo caso de la imagen anterior, teñido con tricrómico, podemos ver los trombos intracapilares en glomérulos y capilares peritubulares; hay leve distorsión de la arquitectura del penacho y algunos polimorfos intraluminales. (Tricrómico de Masson, X400).
Inmunofluorescencia
Depósitos de inmunoglobulinas y complemento en el endotelio de todos los vasos, principalmente IgM, IgG y C3. En algunos casos, muchos de ellos debido a artefactos por necrosis, puede ser difícil de interpretar la inmunofluorescencia.
C4d: es un producto de gradación del complemento que se une covalentemente a las paredes de capilares peritubulares y glomerulares, y permanece más tiempo en el tejido que las otras fracciones, siendo más fácilmente detectado. Recordemos que el C4 se activa, principalmente, por la vía clásica del complemento (por anticuerpos) y por lo tanto nos sugiere una reacción humoral. Su detección se puede hacer por inmunofluorescencia (IF) o por inmunohistoquímica (IHQ – método cromógeno, que a diferencia de la IF utiliza un método enzimático, no con sustancias fluorescentes). Algunos autores consideran más sensible la IF para detectar C4d, sin embargo, la positividad por IF en menos del 10% de capilares peritubulares en una biopsia renal se considera inespecífica; en cambio, por el método cromógeno, usando tejido incluido en parafina, cualquier positividad es considerada de importancia clínica. La positividad que se considera de verdadera importancia es la que se detecta en las paredes de capilares peritubulares. Este hallazgo se considera un marcador relativamente específico de respuesta humoral.
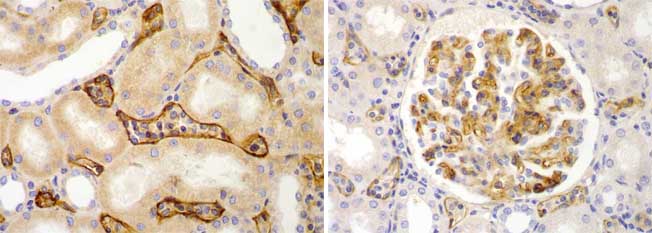
Figura 3. La inmunotinción para C4d se considera positiva cuando se detecta en paredes de capilares peritubulares (CPT). La positividad en capilares glomerulares es menos específica. En ambas microfotografías hay positividad en CPT; en la izquierda se ve más intensa porque usamos una concentración más alta del anticuerpo anti-C4d; observe bien en la imágen de la derecha, la marcación de algunos CPT. (Inmunoperoxidasa para C4d, X400).
Diagnóstico diferencial
Puede haber notoria marginación de leucocitos en capilares debido a lesiones por preservación/reperfusión e incluso acompañados por trombos, en estos casos la alteración suele ser menos difusa. En casos de trombosis venosa del injerto habrá también marcada congestión de vasos, hemorragia intersticial y marginación de polimorfos, estos últimos se ven aun en arterias y venas más grandes, además muchos trombos no se acompañan de marginación de polimorfos, es muy importante en estos casos evaluar la vena renal principal y sus ramas. La negatividad para C4d es una ayuda importante en el diagnóstico diferencial al igual que un cuidadoso análisis del caso con todo el grupo de trasplantes.
Es una forma de rechazo humoral que se instaura más lentamente, después del inicio de la función y, característicamente, entre las semanas 1ª y 2ª post-trasplante. Se presentan con disfunción del injerto, usualmente de rápida evolución; puede haber oliguria o anuria.
Histopatológicamente hay abundantes neutrófilos en capilares peritubulares y glomerulares, también puede identificarse marginación de monocitos. En arterias hay daño endotelial y podemos encontrar infiltrado inflamatorio subendotelial (en la intima): endarteritis o endotelitis o endotelialitis (yo prefiero llamar a esta lesión endarteritis, ya que indica el tipo de vaso comprometido y el sitio de la inflamación). En otros casos hay necrosis fibrinoide de la media arterial, con infiltrado inflamatorio y fragmentación nuclear (cariorrexis), esta lesión es clasificada como vascular severa: v3 en la clasificación de Banff; cuando hay necrosis fibrinoide de la pared arterial, la lesión es muy sugestiva de rechazo humoral.

Figura 4. En rechazo agudo acelerado es característico encontrar rechazo vascular. En caso de respuesta inmune severa contra el endotelio podemos ver trombosis arterial. En esta arteria, a la izquierda, hay también infiltración de células inflamatorias en la pared y fragmentación nuclear (cariorrexis). (H&E, X300).

Figura 5. Glomerulitis marcada en un glomérulo de un paciente con rechazo agudo severo y biopsia renal 9 días post-trasplante. Observe abundantes leucocitos en el penacho. Cuando hay monocitos y polimorfos es más probable que exista componente humoral del rechazo. En la clasificación de Banff la glomerulitis se gradúa de acuerdo con el porcentaje de glomérulos comprometidos y no de la severidad en un glomérulo determinado (Tabla 2). (Tricrómico de Masson, X400).
En lesiones con respuesta puramente humoral encontraríamos leucocitos en capilares, microtrombos y necrosis fibrinoide arterial con muy poco o nada de infiltrado mononuclear en intersticio o túbulos. Sin embargo, es muy probable que en la mayoría de casos con este tipo de rechazo haya, en alguna medida, respuesta inmune celular (rechazo celular) acompañando el rechazo humoral.
Por Inmunofluorescencia encontraremos depósitos de IgG, IgM y C3 en lesiones arteriales y en capilares.
La inmunotinción para C4d es también positiva en paredes de capilares peritubulares y glomerulares, aunque se da más valor diagnóstico a la tinción en los primeros, ya que en glomérulos, por alguna razón, es más frecuente encontrar positividad aun sin demostrarse respuesta humoral.
El rechazo agudo puede ser túbulo-intersticial o vascular, anteriormente se les conocía, respectivamente, como "celular" y "vascular". En la actualidad sabemos que determinar el tipo de respuesta inmune sólo con la morfología es bastante impreciso. Con la modificación de la clasificación de Banff en 1993 (Racusen et al, Am J Transplant 3:708-14, 2003 [PubMed link]) se ha retomado el nombre de "celular" para el rechazo túbulo-intersticial (grados IA y IB) y para el rechazo vascular de grado leve y moderado (grados IIA y IIB) y no se utiliza otro calificativo (ni "celular" ni "humoral") para el rechazo con lesiones vasculares severas (grado III); esto es debido a que las lesiones vasculares con inflamación vascular severa (necrosis fibrinoide o inflamación transmural: v3 - ver clasificación, más adelante) son las que tienen más probabilidad de asociarse con, o deberse a, componente humoral del rechazo.
Clínica: se suele presentar después de la primera semana y, usualmente, antes de los tres meses post-trasplante, sin embargo, puede encontrarse en cualquier momento de la evolución del injerto. La principal presentación clínica es elevación de la creatinina, con o sin disminución del volumen urinario. Puede haber hematuria y proteinuria leve. Afecta aproximadamente una tercera parte de todos los trasplantados renales.
Histopatología
Las alteraciones principales están en túbulos, intersticio, arterias y venas, y consisten en grados variables de inflamación con infiltración de linfocitos activados (se ven más grandes, con nucléolo y con cromatina más granular: abierta, contrario a los pequeños y de cromatina densa, oscura con las tinciones de rutina).
Quizá el hallazgo más frecuente cuando hay respuesta inmunológica contra el injerto es la infiltración de linfocitos en la pared de venas y vénulas: venulitis, sin embargo, en el injerto renal, esta respuesta inmune no se asocia con disfunción ni ha demostrado tener impacto en la evolución del injerto, por lo que no se considera un criterio de rechazo (sí en otros óragnos trasplantados como hígado y páncreas). Las vénulas son uno de los primeros sitios de marginación y migración de células inflamatorias (son un sitio de circulación lenta) y por eso la venulitis representa, probablemente, una respuesta inmune leve o sin importancia funcional.
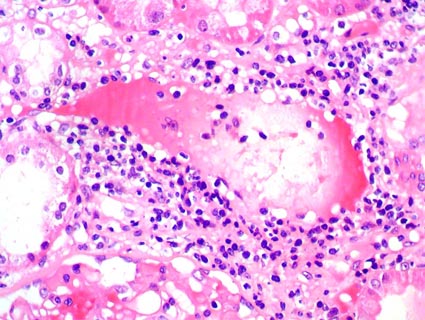
Figura 6. La venulitis es un hallazgo muy frecuente en biopsias de injertos renales, aun sin otros hallazgos de rechazo. Aunque implica una respuesta inmune contra el injerto renal, no se considera un criterio de rechazo. Observe linfocitos ocupando la delgada pared de la vena en el centro de la imagen. (Plata-metenamina, X400).
Consideramos que hay rechazo cuando hay, al menos, infiltrado de linfocitos activados en el intersticio y túbulos. En el intersticio el infiltrado puede ser en focos o difuso y la severidad del infiltrado correlaciona con la severidad de la respuesta inmune y, en gran medida, con la presentación clínica. El rechazo tubular se caracteriza por infiltración de linfocitos al epitelio tubular: tubulitis, con la consecuente lesión de sus células. Toda la experiencia e información acumulada desde hace muchas décadas ha permitido determinar que la tubulitis es un buen indicador de la severidad del rechazo y por ello es el rasgo que ha caracterizado el rechazo túbulo-intersticial (aunque debe acompañarse de inflamación intersticial).
Si hay tubulitis leve (t1: 4 o menos células inflamatorias mononucleares por sección transversal del túbulo o por 10 células tubulares) decimos que hay cambios "sospechosos" de rechazo ("borderline"); si hay tubulitis moderada (t2: 5-10 células) habrá un rechazo grado IA de Banff; y si hay tubulitis severa (t3: >10 células) será un rechazo grado IB: túbulo-intersticial severo. Recordemos que esta tubulitis debe ir acompañada de inflamación intersticial al menos moderada (que también se gradúa: ver adelante). Si la infiltración de linfocitos al epitelio tubular se acompaña de (o produce) ruptura de la basal del túbulo (destrucción tubular) debemos clasificar la tubulitis como severa (t3).
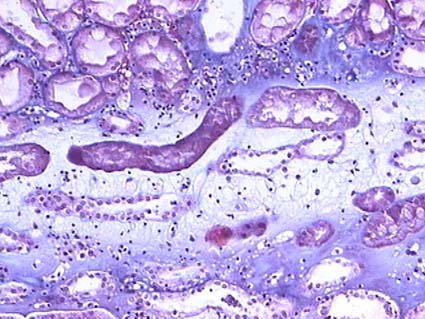
Figura 7. La inflamción intersticial en rechazo se caracteriza por infiltrado de linfocitos activados; en muchos casos podemos ver, también, marcado edema del intersticio. Observe el estroma laxo, fibrilar, edematoso, separando los túbulos, en un caso de rechazo agudo tubulointersticial severo, tipo IB de Banff. (Tricrómico de Masson, X300).
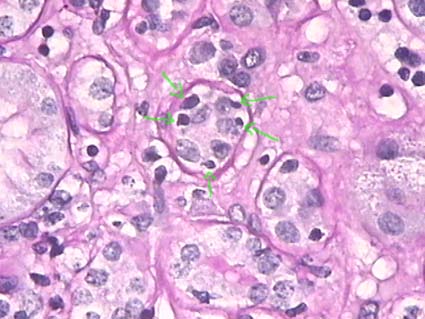
Figura 8. La tubulitis se carcateriza por infiltración de linfocitos al epitelio tubular. Las tinciones en las que se resalta la membrana basal tubular permiten observar mejor la presencia de los linfocitos dentro del epitelio. Es muy frecuente que estas células inflamatorias se vean rodeadas de un espacio claro que las resalta (flechas). La severidad de la tubulitis se gradúa de acuerdo al número por área transversal del túbulo, en este caso 5 linfocitos: t2. (PAS, X400).
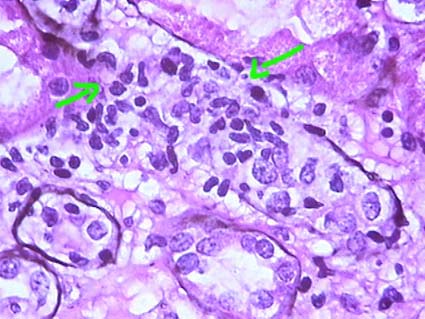
Figura 9. En la tubulitis severa hay más de 10 linfocitos por corte transversal del túbulo o por 10 células epiteliales en cortes longitudinales. Los casos en que podemos evidenciar destrucción de la basal del túbulo (flechas) también debemos graduarlos como tubulitis severa: t3. (Plata-metenamina, X400).
Cuando hay lesión arterial el cuadro clínico suele ser más severo y hay menor respuesta a esteroides, por lo que muchos casos requerirán un tratamiento más agresivo, como anticuerpos anti-CD3. La presencia de linfocitos penetrando el endotelio, hacia la íntima, indica endarteritis y la lesión debe clasificarse como rechazo con componente vascular. La adhesión de leucocitos al endotelio arterial, sin atravesarlo, no indica endarteritis. Si esa lesión endotelial acompañada de células inflamatorias mononucleadas no obstruye la luz del vaso o lo hace en menos del 25% habrá una endarteritis leve (v1) y el rechazo será clasificado como grado IIA de Banff. Si la lesión obstruye más del 25% de la luz arterial en al menos una arteria la clasificamos como v2 y el rechazo será grado IIB. Y si hay lesiones arteriales severas: necrosis fibrinoide de la pared o inflamación transmural (v3) el rechazo lo clasificaremos como grado III.
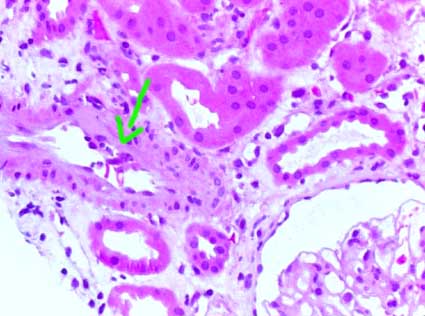
Figura 10. Las lesiones arteriales de rechazo indican una agresión inmune más severa contra el injerto. Aquí podemos ver algunos linfocitos adheridos al endotelio y otros que han penetrado hasta la íntima: v1 (flecha). (H&E, X400).
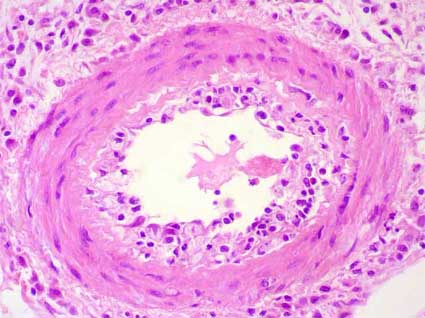
Figura 11. Las lesiones arteriales de rechazo pueden producir acúmulos de linfocitos y otras células en la íntima y el endotelio, lo que, sumado a la reacción de las células endoteliales y, en algunos casos, agregación de plaquetas y fibrina, puede producir disminución de la luz del vaso. Si esta reducción luminal es superior al 25% se considera que el grado de rechazo vascular es v2. (H&E, X400).
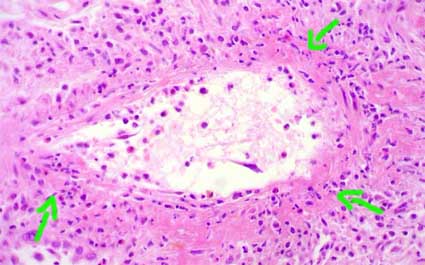
Figura 12. Las lesiones arteriales severas (v3) se carcaterizan por inflamación transmural de arterias o, como en este caso, necrosis fibrinoide de la pared. Hay infiltrado inflamatorio con cariorrexis y material eosinofílico (fibronoide) en casi toda la circunferencia de esta arteria de mediano calibre. Las flechas señalan las zonas con lesión más prominente. (H&E, X400).
También podemos encontrar lesiones inflamatorias en arteriolas: endarteriolitis o arteriolitis, sin embargo, el esquema de Banff no la incluye como un criterio de rechazo, aunque, dice que debemos registrar este hallazgo. En la clasificación multicéntrica del rechazo llamada CCTT (Cooperative Clinical Trial in Transplantation) de 1997 si se consideraba un criterio de rechazo (Colvin RB et al, J Am Soc Nephrol 8:1930-41, 1997. [PubMed link]). En nuestra experiencia, en muchos de los casos en los que encontramos endarteriolitis había también endarteritis, se comportaban como un rechazo cortico-resistente o encontramos las lesiones arteriales en una segunda biopsia (datos no publicados).
En glomérulos podemos encontrar infiltrado de células mononucleares en el penacho: glomerulitis; estas células suelen estar intracapilares. En la modificación de la clasificación de Banff 2013 se define glomerulitis como "la oclusión parcial o completa de uno o más capilares glomerulares por leucocitos y agrandamiento de las células endoteliales" (Haas M, et al, Am J Transplant. 2014;14(2):272-83 [PubMed link]). Esta lesión es sugestiva de agresión contra el endotelio por anticuerpos; la glomerulitis, así como la presencia de monocitos y/o de polimorfos en el penacho sugiere componente humoral del rechazo, al igual que el hallazgo de estas células en capilares peritubulares. Un par de lesiones glomerulares poco frecuentes, pero ominosas porque indican, al menos en nuestra experiencia, rechazo severo, son la presencia de semilunas epiteliales y la capsulitis: inflamación mononuclear de la cápsula de Bowman con lesión y, muchas veces, destrucción de ella.
Es muy importante tratar de detectar un componente humoral del rechazo en todas las biopsias de trasplante renal con la inmunomarcación para C4d, así no existan las alteraciones morfológicas que sugieren rechazo humoral.
Características morfológicas que sugieren componente humoral del rechazo (Racusen et al, Am J Transplant 3:708-14, 2003. [PubMed link]):
1. Lesiones tubulares similares a las de la
necrosis tubular aguda.
2. Neutrófilos y/o mononucleares en capilares peritubulares y/o glomérulos
y/o trombosis capilar
3. Arteritis intimal / necrosis fibrinoide / inflamación arterial transmural
Para el diagnóstico definitivo de rechazo mediado por anticuerpos necesitamos tres criterios (Racusen et al, Am J Transplant 3:708-14, 2003. [PubMed link]):
1. Evidencia morfológica que lo sugiera
(uno o varios de los tres hallazgos descritos atrás)
2. Evidencia inmunopatológica de reacción mediada por anticuerpos:
C4d en capilares peritubulares o inmunoglobulinas y complemento en lesiones
arteriales necrotizantes. También puede ser por pruebas moleculares demostrando transcripción de genes que se han relacionado con rechazo (no disponible en la mayoría de centros) (clasificación de Banff 2017).
3. Evidencia serológica de anticuerpos anti-donante circulantes (contra
antígenos HLA u otros). De acuerdo con la clasificación de Banff 2017, la positividad para C4d o la expresión de genes relacionados con rechazo pueden sustituir la evidencia de anticuerpos anti-donante.
Para un diagnóstico definitivo se requieren los tres criterios. Si sólo encontramos las alteraciones morfológicas y la positividad para C4d podemos catalogarlo como "sospechoso para" o "consistente con" rechazo agudo mediado por anticuerpos.
La positividad para C4d puede ser difusa, pero si es focal y débil suele asociarse menos con rechazo humoral y pronóstico, aunque algunos consideran que incluso la tinción focal y débil se correlaciona con peor pronóstico.
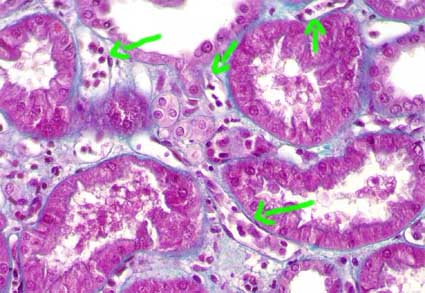
Figura 13. En los injertos renales con rechazo humoral es frecuente ver capilares peritubulares dilatados y con múltiples polimorfos y/o monocitos en su luz (flechas). Este hallazgo, sumado a positividad para C4d es muy sugerente de rechazo humoral, que debería confirmarse tratando de demostrar anticuerpos específicos contra antígenos del donante. (Tricrómico de Masson, X400).
En la Conferencia de Banff de 2011 se propuesieron nuevos aspectos en el diagnóstico de rechazo mediado por anticuerpos (agudo y crónico) y podría ser que el C4d no es tan útil en su diagnóstico, siendo más importantes la inflamación de la microcirculación ("MI") y la detección de anticuerpos anti-donante. Vale la pena leer el artículo completo: Mengel M, et al. Banff 2011 Meeting Report: New Concepts in Antibody-Mediated Rejection. Am J Transplant. 2012;12(3):563-570. [PubMed link] [Am J Transplant link].
CLASIFICACIÓN
DE BANFF DEL RECHAZO
La clasificación acptada internacionalmente para graduar
el rechazo del injerto renal es conocida como la clasificación de Banff,
ya que en esta localidad de Canadá fue donde se realizaron los primeros
encuentros para su propuesta. Esta clasificación aparece en: Racusen
LC, et al, Kidney Int 55:713-23, 1999 [PubMed
link]; modificada en: Racusen LC et al, Am J Transplant 3:708-14,
2003. [PubMed
link] [Free
full text]; nuevamente modificada en: Solez K, et al.
Am J Transplant 7:518-526, 2007 [PubMed
link][Free
full text] y modificaciones sucesivas (Solez K, et al. Am J Transplant. 2008;8:753-60.
[PubMed
link]; Haas M, et al, Am J Transplant. 2014;14(2):272-83 [PubMed link]). La revisión más reciente corresponde a la publicación de la reunión de 2017: Haas M, et al. The Banff 2017 Kidney Meeting Report: Revised diagnostic criteria for chronic active T cell-mediated rejection, antibody-mediated rejection, and prospects for integrative endpoints for next-generation clinical trials. Am J Transplant. 2018;18(2):293-307 [PubMed link] y Loupy A, et al. The Banff 2019 Kidney Meeting Report (I): Updates on and clarification of criteria for T cell- and antibody-mediated rejection. Am J Transplant. 2020;20(9):2318-2331 [PubMed link]. En esta nueva modificación se refinan aspectos relacionados
con el diagnóstico del rechazo mediado por anticuerpos y se incluyen
la i-IFTA al menos moderada más tubulitis moderada o severa como criterios para el diagnóstico de rechazo crónico mediado por células T, además, con esta modificación, ahora es posible diagnosticar rechazo mediado por anticuerpos sin DSA, sólo con positividad para C4d o con pruebas moleculares en la biopsia, como posibles alternativas y/o complemento a los DSA.
| Tabla
1. Categorías diagnósticas
de Banff para las biopsias del injerto renal (Racusen LC, et al, Kidney Int 55:713-23, 1999 [PubMed link]; modificada en: Racusen et al, Am J Transplant 3:708-14, 2003. [PubMed link] [Free full text]; nuevamente modificada en: Solez K, et al. Am J Transplant 7:518-526, 2007 [PubMed link][Free full text]), de nuevo modificada en: Solez K, et al. Am J Transplant. 2008;8:753-60. [PubMed link]; nueva modificación: Haas M, et al, Am J Transplant. 2014;14(2):272-83 [PubMed link] Loupy a, et al. Am J Transplant. 2017;17(1):28-41 [PubMed link]. La última versión: Haas M, et al. The Banff 2017 Kidney Meeting Report... Am J Transplant. 2018 Feb;18(2):293-307 [PubMed link].Loupy A, et al. The Banff 2019 Kidney Meeting Report (I): Updates on and clarification of criteria for T cell- and antibody-mediated rejection. Am J Transplant. 2020;20(9):2318-2331 [PubMed link]. |
| Categoría 1. Normal o cambios inespecíficos |
| Categoría 2. Cambios mediados por anticuerpos Rechazo
activo mediado por anticuerpos; deben encontrarse todos los siguientes 3 criterios: 2. Evidencia de interacción de anticuerpos actual/reciente con el endotelio vascular, incluyendo 1 o más de los siguientes: 3. Evidencia serológica de anticuerpos específicos del donante (DSA a HLA u otros antígenos). La tinción de C4d o la expresión de transcriptores / clasificadores validados como se indicó anteriormente en el criterio 2 pueden sustituir a a los DSA; sin embargo, se recomienda fuertemente la realización de pruebas para detectar DSA, incluyendo anticuerpos no HLA si la prueba para anticuerpos HLA es negativa, si se encuentran los criterios 1 y 2. Rechazo crónico activo
mediado por anticuerpos; deben encontrarse todos los siguientes 3 criterios: 2. Idéntico al criterio 2 para ABMR activo (ver arriba) 3. Idéntico al criterio 3 para ABMR activo, incluida la recomendación fuerte para determinar DSA si se encuentran los criterios 1 y 2 Rechazo crónico (inactivo)
mediado por anticuerpos: 2. Ausencia del criterio 2 de evidencia de interacción de anticuerpos actual/reciente con el endotelio 3. Diagnóstico previo, documentado, de rechazo por anticuerpos activo o crónico activo y/o evidencia previa de DSA C4d sin evidencia de rechazo; las 4 características deben estar presentes para el diagnóstico: |
| Categoría 3.
Cambios "borderline" Sospechoso ("borderline") para rechazo agudo mediado por células T: - Focos de tubulitis (t1, t2, t3) con mínima inflamación intersticial (i0, i1), o moderada-severa inflamación intersticial (i2, i3) con tubulitis leve (t1); se mantiene el umbral i1 para borderline con t> 0, aunque esto debe dejarse claro en los informes y publicacionesse - No hay arteritis intimal o transmural (v = 0) |
Categoría 4.
Rechazo mediado por células T Rechazo crónico activo mediado por células
T (Nota: i-IFTA es la inflamación en el intersticio fibrótico: i-IFTA 0: <10% del parénquima fibrótico con inflamación, i-IFTA 1: 10-25% del parénquima fibrótico con inflamación, i-IFTA 2: 26-50%, i-IFTA 3: >50%; t-IFTA es la tubulitis en áreas de IFTA, sin incluir túbulos severamente atróficos y se gradua 0-3 de una manera similar a la t) - Grado IB. Inflamación intersticial en > 25% del total de la corteza (puntaje ti 2 o 3) y > 25% del parénquima cortical fibrótico (i-IFTA 2 o 3) con tubulitis severa (t3 o t-IFTA3) en 1 o más túbulos, sin incluir túbulos severamente atróficos; se deben descartar otras causas conocidas de i-IFTA |
Categoría 5.
Fibrosis intersticial y atrofia tubular, sin evidencia de etiología
específica (las categorías 5 y 6 no aparecen en la revisión de la clasificación de 2017, sin embargo son categorías útiles en el diagnóstico diario). |
| 6.
Otros Cambios que no se consideran debidos a rechazo. Pueden incluir lesiones g, cg ó cv aisladas y coincidir con categorías 2, 3, 4 y 5 - Enfermedades linfoproliferativas - Cambios inespecíficos: Inflamación intersticial sin tubulitis, cambios vasculares reactivos, venulitis) - Necrosis tubular aguda - Nefritis intersticial aguda - Toxicidad por medicamentos - Infecciones - Enfermedad glomerular recurrente o de novo - Obstrucción/reflujo - Lesiones por preservación/reperfusión - Otras |
| Tabla 2. Criterios cuantitativos para la glomerulitis ("g")* | |
g0 |
No hay glomerulitis |
g1 |
Glomerulitis en menos del 25% de glomérulos |
g2 |
Glomerulitis segmentaria o global en 25 a 75% de glomérulos |
g3 |
Glomerulitis segmentaria o global en >75% de glomérulos |
*Se define como la oclusión parcial o completa de uno o más capilares glomerulares por leucocitos y agrandamiento de las células endoteliales. Este hallazgo sugiere la posibilidad de rechazo mediado por anticuerpos.
| Tabla 3. Criterios cuantitativos para inflamación intersticial de células mononucleadas ("i") | |
|
i0 |
No hay o es trivial (<10% del parénquima no fibrosado) |
|
i1 |
En el 10 a 25% del parénquima |
|
i2 |
En el 26 al 50% del parénquima |
|
i3 |
En > del 50% del parénquima |
Indicar con un asterisco (*) la presencia de una notoria cantidad de eosinófilos, neutrófilos o células plasmáticas
| Tabla 4. Criterios cuantitativos para tubulitis ("t")* | |
t0 |
No hay células mononucleares en túbulos |
t1 |
Focos con 1-4 células por sección tubular (o por 10 células tubulares) |
t2 |
Focos con 5-10 células por sección tubular (o por 10 células tubulares) |
t3 |
Focos con >10 células por sección tubular (o po 10 células tubulares) o presencia de al menos 2 áreas de destrucción de la basal tubular con i2/i3 y t2 en otros sitios de la biopsia |
*No evaluar túbulos severamente atróficos
| Tabla 5. Criterios cuantitativos para arteritis intimal ("v") | |
v0 |
No hay arteritis |
v1 |
Arteritis intimal leve a moderada en al menos una arteria |
v2 |
Arteritis intimal severa con disminución de su luz en al menos el 25% |
v3 |
Arteritis transmural y/o necrosis fibrinoide de la media con infiltrado linfocítico |
Anotar el número total de arterias en la muestra y el número de afectadas por la inflamación. Indicar con un asterisco (*) la presencia de infarto y/o hemorragia intersticial
| Tabla 6. Cantidad de tejido adecuado (informar número de glomérulos y arterias) | |
| No satisfactorio | <7 glomérulos y/o < de 2 arterias |
| Mínimo | Al menos 7 glomérulos y 1 arteria |
| Adecuado | Al menos 10 glomérulos y 2 arterias |
|
Mínimo
de cristales |
7 cristales - 3 H&E - 3 PAS - 1 tricrómico* |
*Lo recomendable, como lo dice el esquema de Banff, es tener al menos 7 láminas (o placas histológicas) y tinciones con H&E, tricrómico y PAS (y/o plata metenamina); el número de cristales que se tiñen con cada una de estas tinciones es variable de acuerdo a las preferencias del patólogo o centro respectivo.
| Tabla 7. Criterios cuantitativos para capilaritis peritubular ("ptc"). Solez K, et al. Am J Transplant. 2008;8:753-60. [PubMed link] | |
ptc0 |
No hay ptc significativa o <10% de capilares peritubulares (CPT) con inflamación |
ptc1 |
>/=10% de CPT corticales con capilaritis, con máximo 3 a 4 células inflamatorias en la luz |
ptc2 |
>/=10% de CPT corticales con capilaritis, con máximo 5 a 10 células inflamatorias en la luz |
ptc3 |
>/=10% de CPT corticales con capilaritis, con máximo >10 células inflamatorias en la luz |
Es recomendable hacer un comentario sobre la composición ( células mononucleadas o neutrófilos) y sobre la extensión (focal: </=50% o difuso: >50%).
| Tabla 8. Graduación ("scoring") de la tinción para C4d (% de la biopsia). | |
C4d0 |
Negativo : 0% de CPT (capilares peritubulares) |
C4d1 |
Mínima tinción/detección de C4d: 1: < 10% de CPT |
C4d2 |
Tinción para C4d focal: 10-50% de CPT |
C4d3 |
Tinción difusa para C4d: >50% de CPT |
La inmunohistoquímica (IHC) para C4d en tejido incluido en parafina es menos sensible que la inmunofluorescencia (IF) en cortes de tejido congelado, no fijado, en cerca de un grado, p.e. un caso con tinción mínima en IHC será focal en IF. Por lo tanto la interpretación y graduación deben hacerse de acuerdo a la técnica.
| Tabla 9. Criterios cuantitativos para inflamación intersticial de células mononucleadas en todo el parénquima ("ti"). Incluye corteza fibrótica y no fibrótica. | |
ti0 |
No hay inflamación intersticial o es trivial (<10% del parénquima) |
ti1 |
10-25% del parénquima inflamado |
ti2 |
26-50% del parénquima inflamado |
ti3 |
>50% del parénquima inflamado |
Ver en la Parte 2 los criterios para la graduación de las lesiones crónicas: glomerulopatía crónica del injerto, fibrosis intersticial, atrofia tubular, fibrosis intimal, arterioloesclerosis hialina e incremento de la matriz mesangial.
La graduación de las lesiones vasculares y tubulares se basa en las lesiones más severas encontradas, así sean focales.
La presencia de infiltrado intersticial de células plasmáticas y de polimorfos puede indicar un proceso infeccioso subyacente y debe alertarnos a buscar la causa; su presencia debe marcarse con un * en "i". Igual sucede con la presencia de notoria cantidad de eosinófilos.
El infiltrado de linfocitos en el rechazo es predominantemente de tipo T (CD3), sin embargo es muy frecuente encontrar, en cantidad variable, linfocitos B y células plasmáticas. El significado de la infiltración por estos dos últimos tipos de células no es claro, algunos han postulado que su presencia en abundante cantidad sugiere un componente humoral del rechazo, pero eso no se ha podido comprobar consistentemente en la práctica. La relación linfocitos CD4 /CD8 es variable, algunos han encontrado predominio de CD4 y otros de CD8. Para efectos prácticos, esta relación no ayuda en el diagnóstico de rechazo.
También ha recibido atención la correlación entre la infiltración por células plasmáticas y el pronóstico de la evolución del injerto (asumiendo que este infiltrado tendría relación con respuesta humoral contra el injerto y sabiendo que el rechazo humoral empeora el pronóstico), sin embargo, no se ha documentado que haya una ralación clara y universal con peor evolución del injerto.
El ureter y la pelvis pueden ser también blanco del rechazo agudo, habrá infiltrado linfocítico en la mucosa y edema; el infiltrado puede mostrar exocitosis al urotelio y éste puede ser exfoliado o ulcerarse. Las arterias uroteliales también pueden presentar endarteritis y necrosis fibrinoide, al igual que cambios de rechazo crónico.
Principales fuentes bibliográficas:
Bibliografía